
Contoh Soal Hukum Faraday Homecare24
17 September 2021 Hukum Faraday: Penerapan Dan Contoh Soal - Hukum Faraday menjelaskan tentang hubungan proses kimia dengan energi listrik. Proses ini sudah banyak dikenal diberbagai industri sebagai proses elektrolisis, yaitu proses perpindahan muatan listrik pada suatu larutan yang menghasilkan proses kimia pada larutan tersebut.
Hukum Faraday Hukum Induksi Faraday Rumus, Soal, Jawaban
Hukum Faraday: Bunyi, Rumus, & Contoh Soal. Pada tahun 1834, seorang ilmuwan bernama Michael Faraday merumuskan suatu hukum terkait hubungan antara arus listrik yang dialirkan ke dalam larutan dengan banyaknya zat kimia yang dihasilkan. Percobaan dari Michael Faraday ini kemudian menghasilkan Hukum Faraday I dan Hukum Faraday II.

48+ Soal Kimia Hukum Faraday Contoh Soal dan Jawaban
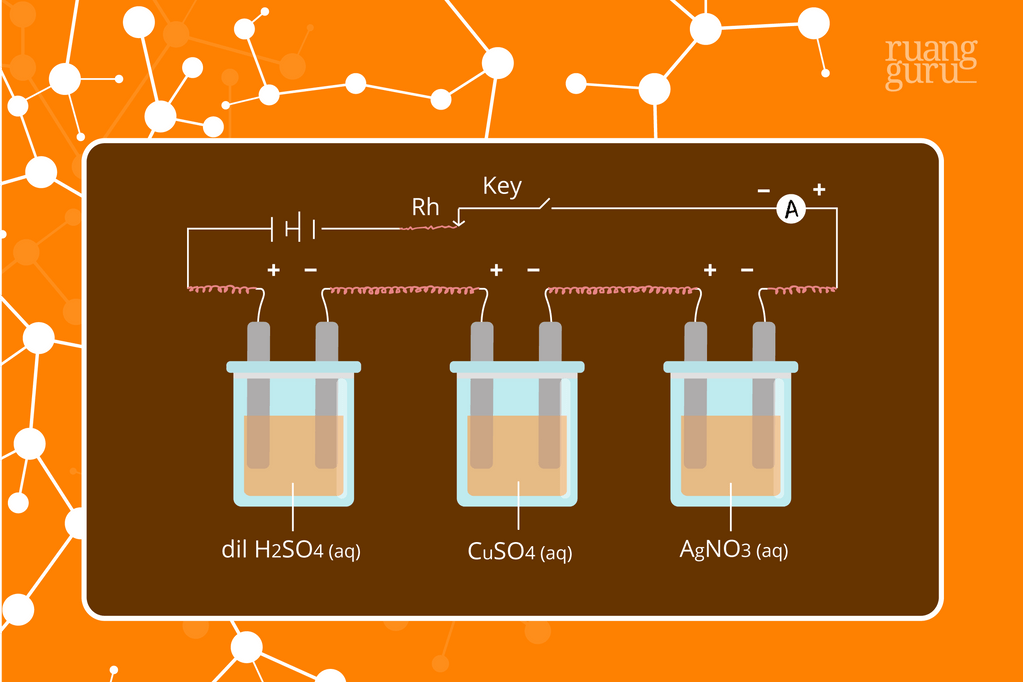
Soal ini diselesaikan dengan hukum Faraday II karena dua sel elektrolisis menggunakan arus yang sama, dengan rumusan: diketahui : w Ag = 1,08 gram. Soal No.8. Pada elektrolisis larutan CuSO 4 dihasilkan 25,4 gram endapan Cu pada katode.

Soal Dan Pembahasan Hukum Faraday Ruang Ilmu
Hukum Faraday 1 menyatakan bahwa jumlah zat yang dihasilkan pada elektrode berbanding lurus dengan jumlah arus listrik yang melalui elektrolisis. Baca Juga: Contoh Capaian Pembelajaran Bahasa Indonesia Tingkat Lanjut Fase F SMA Kelas 11 dan Kelas 12 Kurikulum Merdeka Secara matematis, prinsip Hukum Faraday 1 dapat dirumuskan sebagai berikut:

24+ Contoh Soal Hukum Faraday Contoh Soal Terbaru
Contoh soal penerapan Hukum Faraday 1 adalah sebagai berikut ini: 1.Tentukan Jumlah faraday untuk mereduksi ion Ca2+ dalam bentuk leburan (Ar Ca= 40) sebanyak 12 gram. Penyelesaian : Diketahui : W = 12 gram Ar Ca = 40 Ditanya : Jumlah Faraday =? Jawab : Jumlah Faraday = mol elektron.
Apa Bunyi Hukum Faraday 1 dan 2? Kimia Kelas 12
Selanjutnya mari kita simak contoh soal hukum faraday 2 dan pembahasannya berikut ini. Soal No. 1 Pada elektrolisis larutan NiSO 4 selama 45 menit menghasilkan endapan Ni sebanyak 9,75 gram. Berapa gram Ag yang dihasilkan jika arus dalam waktu yang sama dialirkan pada elektrolisis larutan AgNO 3? (Ar Ni = 58,5; Ag = 108) Pembahasan Diketahui:

Apa Bunyi Hukum Faraday 1 dan 2? Kimia Kelas 12
Pembahasan Ca 2+ → valensi = 2 Ar Ca = 40 W = e x F Jadi, untuk mereduksi 12 gram ion Ca 2+ diperlukan 0,6 Faraday. 2. Pada elektrolisis dengan elektroda karbon dihasilkan endapan Cu sebanyak 12,7 gram dengan arus listrik yang digunakan sebesar 4 A. Berapa lama waktu yang diperlukan untuk elektrolisis tersebut? Pembahasan Ar Cu = 63,5

Contoh Contoh Soal Hukum Faraday
Contoh soal hukum Faraday nomor 1 Sebuah kumparan terdiri dari 1.200 lilitan berada dalam medan magnetik, apabila pada kumparan terjadi perubahan fluks magnetik 2 x 10 -3 Wb setiap detik, maka besarnya ggl induksi yang timbul pada ujung-ujung kumparan adalah. A. 0,24 volt B. 1,0 volt C. 1,2 volt D. 2,0 volt E. 2,4 volt Pembahasan Diketahui:

Pengertian Hukum Faraday Dilengkapi Bunyi Rumus Dan Contoh Soal Riset
Pembahasan soal hukum faraday elektrolisis nomor 1 Di katode terbentuk 2 elektron (2e -) sehingga n = 2. → e = Ar n = 63,5 2 = 31,75 → w = e . F = 31,75 . 0,4 = 12,7 gram Soal ini jawabannya B. Contoh soal hukum faraday elektrolisis nomor 2 Jumlah arus listrik yang diperlukan untuk mereduksi 1 mol ion ClO 3- menjadi Cl 2 dalam larutan asam adalah.

LATIHAN SOAL DAN PEMBAHASAN HUKUM FARADAY 1 (KIMIA SMA KELAS 12 ELEKTROLISIS) YouTube
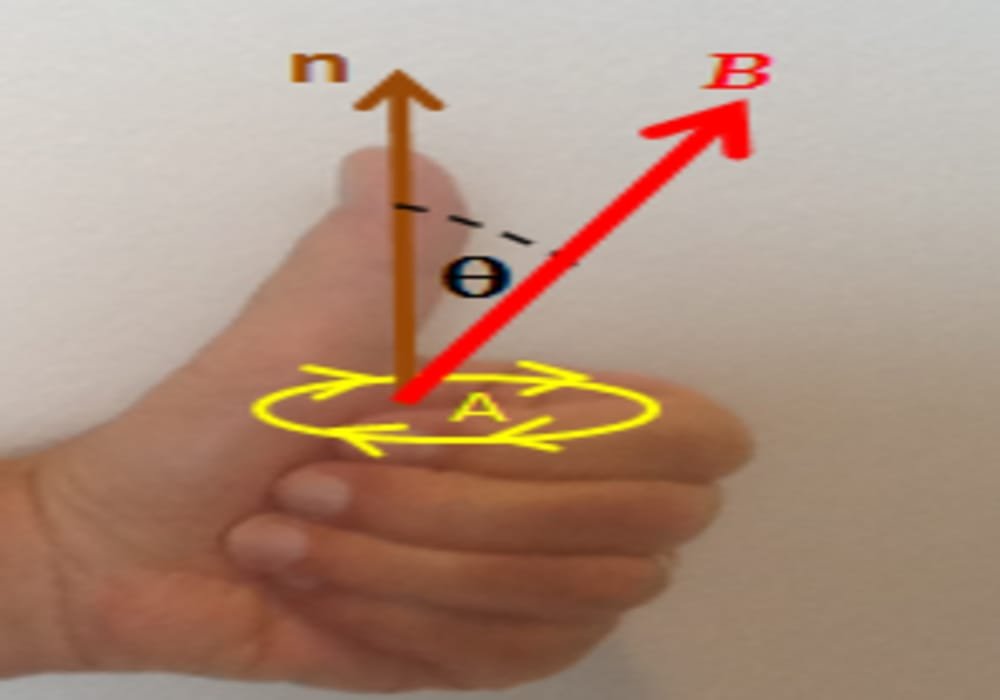
Hukum Faraday 1 Hukum Faraday 2 Hubungan Hukum Faraday dan Elektrolisis Bukannya hukum Faraday itu mengenai elektromagnetik ya? Ya, betul sekali. Awalnya bapak Faraday berhasil membuat sebuah penemuan dalam bidang fisika, tapi kemudian penemuan tersebut diterapkan ke dalam ilmu kimia.

HUKUM FARADAY 1 & 2Contoh soal HUKUM FARADAY UTBKSBMPTN YouTube
Contoh Soal Hukum Faraday 1 dan 2 Penerapan Hukum Faraday Pengertian Hukum Faraday Dalam ilmu elektronika, hukum Faraday adalah ketetapan yang mengatur tentang dasar elektromagnetisme dalam memprediksi bagaimana medan magnet berinteraksi dengan rangkaian listrik untuk menghasilkan gaya gerak listrik ( induksi elektromagnetik ).

Contoh Soal Hukum Faraday Besar Arus Listrik Akibat Perubahan Medan YouTube
1. Masa Kecil Michael Faraday 2. Pencapaian Ilmiah Michael Faraday a. Kimia b. Kelistrikan dan Magnet c. Diagmatisme Prinsip Kerja Hukum Faraday 1. Hukum Faraday I 2. Hukum Faraday II Penemuan Induksi Elektromagnetik Contoh Soal Hukum Faraday 1. Soal 1 2. Soal 2 3. Soal 3 4. Soal 4 5. Soal 5 6. Soal 6 Rekomendasi Buku & Artikel Terkait

PERHITUNGAN SEL ELEKTROLISIS (HUKUM FARADAY 2) YouTube
Berikut ini pembahasan soal tentang elektrolisis dan Hukum Faraday dengan menggunakan variabel muatan, kuat arus, waktu elektrolisis, massa zat yang mengendap, volume gas yang dihasilkan untuk keadaan STP dan RTP. Bila krang jelas bisa menyimak penjelasan memalui video yang tersedia pada setiap nomor. Soal #1

Pembahasan Soal Elektrolisis Hukum Faraday 1 dan 2 YouTube
Oke kalian sudah paham ya tentang Hukum Faraday 1 dan hukum faraday 2, selanjutnya kita akan lihat beberapa contoh soal hukum faraday nih, Squad. Contoh Soal Hukum Faraday. Tembaga (Cu) mempunyai Ar =63,5. Berapakah massa ekivalen untuk reaksi berikut? Cu 2+ (aq) + 2e - → Cu(s) Jawab: Pada reaksi di atas, perubahan bilangan oksidasinya.

Latihan Soal Hukum Faraday PDF
Contoh 1 Contoh 2 Contoh 3 Pengertian Hukum Faraday Hukum Faraday adalah hukum yang menjelaskan tentang hubungan antara jumlah listrik yang digunakan dengan massa zat yang dihasilkan, baik di katode maupun anode pada proses elektrolisis. Hukum ini ditemukan oleh Michael Faraday, seorang ahli kimia dan fisika asal Inggris pada tahun 1834.

Contoh Soal Hukum Faraday 1 LEMBAR EDU
1. Soal: Apa yang diukur oleh Hukum Faraday? Jawaban: Hukum Faraday mengukur besarnya arus listrik yang dihasilkan oleh perubahan fluks magnetik. Jawaban: Hukum Faraday dirumuskan oleh Michael Faraday. 10 Pantun untuk Muthe JKT48 yang Lucu dan Gombal Abis Next 20 Contoh Soal Relasi dan Fungsi Kelas 8 Beserta Jawaban